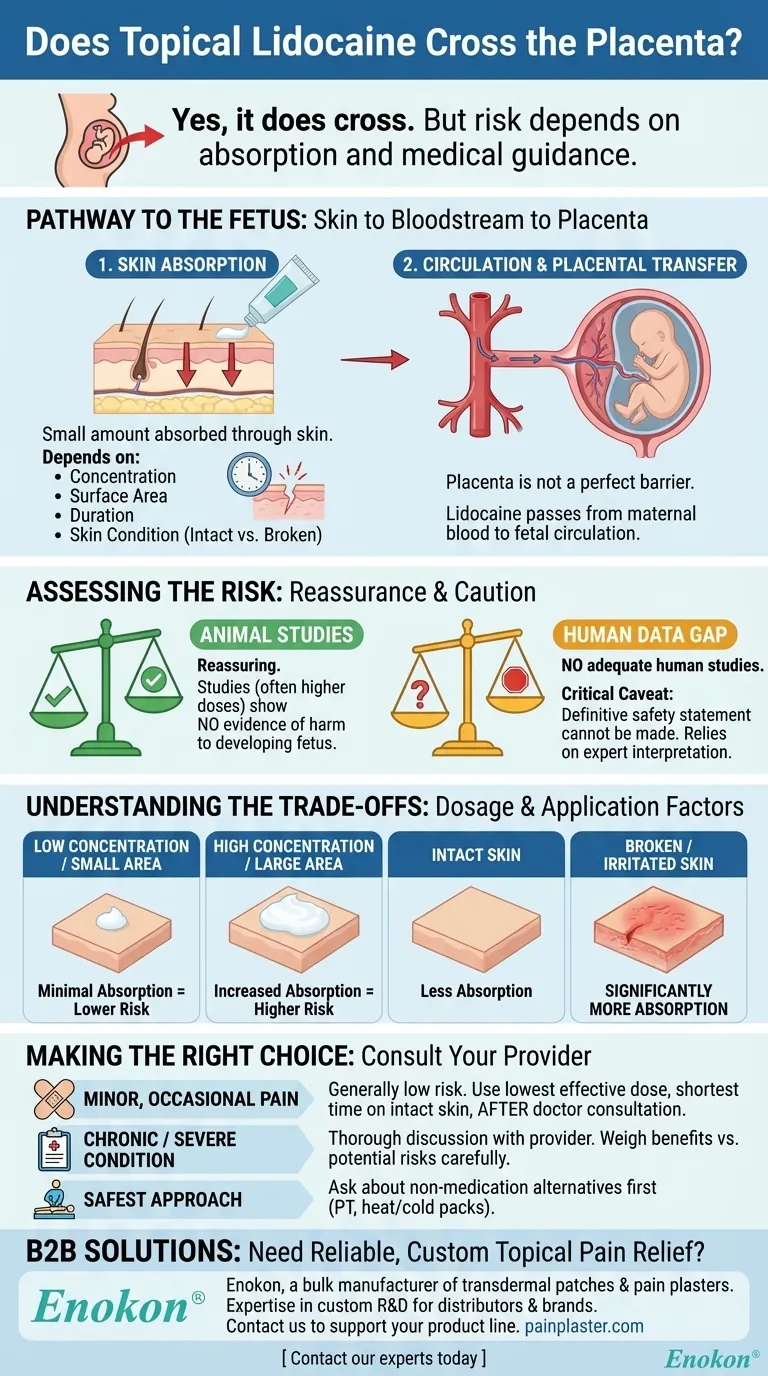
La lidocaína tópica atraviesa la placenta, pero las pruebas disponibles de estudios en animales no indican daños significativos para el feto.Sin embargo, faltan estudios exhaustivos en humanos que confirmen plenamente su seguridad durante el embarazo.Esto obliga a adoptar un enfoque prudente en su uso clínico, sopesando los posibles beneficios frente a los riesgos teóricos.

Explicación de los puntos clave:
-
Transferencia placentaria de lidocaína tópica
- La lidocaína, cuando se aplica tópicamente, puede atravesar la barrera placentaria.Esto se debe a sus propiedades moleculares, que le permiten atravesar las membranas biológicas, incluida la placenta.
- El grado de transferencia depende de factores como la dosis, el lugar de aplicación y el metabolismo materno.
-
Estudios en animales y seguridad fetal
- La investigación en animales no ha demostrado daño directo a los fetos expuestos a la lidocaína.Estos estudios son fundamentales para las evaluaciones iniciales de seguridad, pero tienen limitaciones para predecir los resultados en humanos.
- Los resultados sugieren que las dosis terapéuticas típicas no causan efectos teratogénicos ni anomalías del desarrollo en modelos animales.
-
Falta de estudios en humanos
- No existen estudios bien controlados o a gran escala en mujeres embarazadas para establecer definitivamente la seguridad de la lidocaína durante el embarazo.
- Esta falta de datos significa que los profesionales sanitarios a menudo se basan en estudios con animales y en el juicio clínico a la hora de considerar su uso.
-
Consideraciones clínicas
- La decisión de utilizar lidocaína tópica durante el embarazo debe sopesar la necesidad (por ejemplo, alivio del dolor para procedimientos menores) frente a los riesgos potenciales.
- Se pueden considerar tratamientos alternativos o anestésicos de menor riesgo si están disponibles.
-
Directrices reguladoras y profesionales
- Las agencias reguladoras clasifican la lidocaína como un fármaco de "Categoría B" para el embarazo, lo que indica que no existe un riesgo demostrado en animales pero que los datos en humanos son insuficientes.
- Las directrices profesionales suelen recomendar un uso mínimo y una estrecha vigilancia si se considera necesaria la lidocaína.
Aunque la lidocaína tópica se considera generalmente de bajo riesgo, su uso en el embarazo debe evaluarse cuidadosamente caso por caso.¿Ha discutido escenarios específicos en los que la lidocaína podría ser esencial para la comodidad o seguridad materna?
Tabla resumen:
| Consideraciones clave | Detalles |
|---|---|
| Transferencia placentaria | La lidocaína atraviesa la placenta debido a sus propiedades moleculares. |
| Resultados de estudios en animales | No se observaron daños significativos en fetos animales a dosis terapéuticas. |
| Falta de datos en humanos | Estudios limitados en mujeres embarazadas; dependencia de los datos en animales y del juicio clínico. |
| Categoría de embarazo (FDA) | Categoría B: No se ha demostrado riesgo en animales, pero los estudios en humanos son insuficientes. |
| Recomendación clínica | Utilizar con precaución, sopesando los beneficios frente a los riesgos; considerar alternativas si es posible. |
¿Necesita soluciones seguras para aliviar el dolor durante el embarazo?
En
Enokon
nos especializamos en
parches transdérmicos y apósitos para el dolor conformes a la FDA
ofreciendo
apoyo personalizado en I+D
para distribuidores y marcas del sector sanitario.Nuestras fórmulas priorizan
la seguridad y la eficacia
incluso en poblaciones sensibles como las embarazadas.
Póngase en contacto con nuestros expertos para hablar sobre opciones de analgésicos tópicos de bajo riesgo adaptadas a sus necesidades.
Guía Visual
Productos relacionados
- Parche analgésico de hidrogel de lidocaína para el alivio del dolor
- Parche Infrarrojo Lejano para el Alivio del Dolor de Espalda
- Parche infrarrojo lejano para el dolor de rodilla Parches de calor para aliviar el dolor
- Parches analgésicos con capsaicina y chile
- Parches Calor Profundo Infrarrojo Parches Analgésicos Medicinales
La gente también pregunta
- ¿Qué papel juega el etanol en la absorción transdérmica de la lidocaína? Alivio rápido del dolor con mejor penetración
- ¿Qué riesgos cardiovasculares se asocian a la lidocaína tópica?Comprender los peligros de la absorción sistémica
- ¿Cuál es el mecanismo único del Parche de Gel de Lidocaína al 5% para el dolor nervioso traumático? Explicación del Alivio Dirigido de Doble Acción
- ¿Cómo actúa un parche de lidocaína para aliviar el dolor?Explicación del alivio selectivo del dolor
- ¿Cómo se utilizan normalmente los parches de lidocaína para aliviar el dolor durante el embarazo?Aplicación segura y consideraciones clave
- ¿Cuál era el objetivo del estudio del parche de lidocaína al 5% en pacientes con artrosis?Evaluación del alivio adyuvante del dolor
- ¿Qué son los parches de lidocaína y cómo se clasifican?Su guía para el alivio selectivo del dolor
- ¿Qué informes posteriores a la comercialización se han asociado a los parches transdérmicos de lidocaína?Principales efectos adversos y seguridad

















