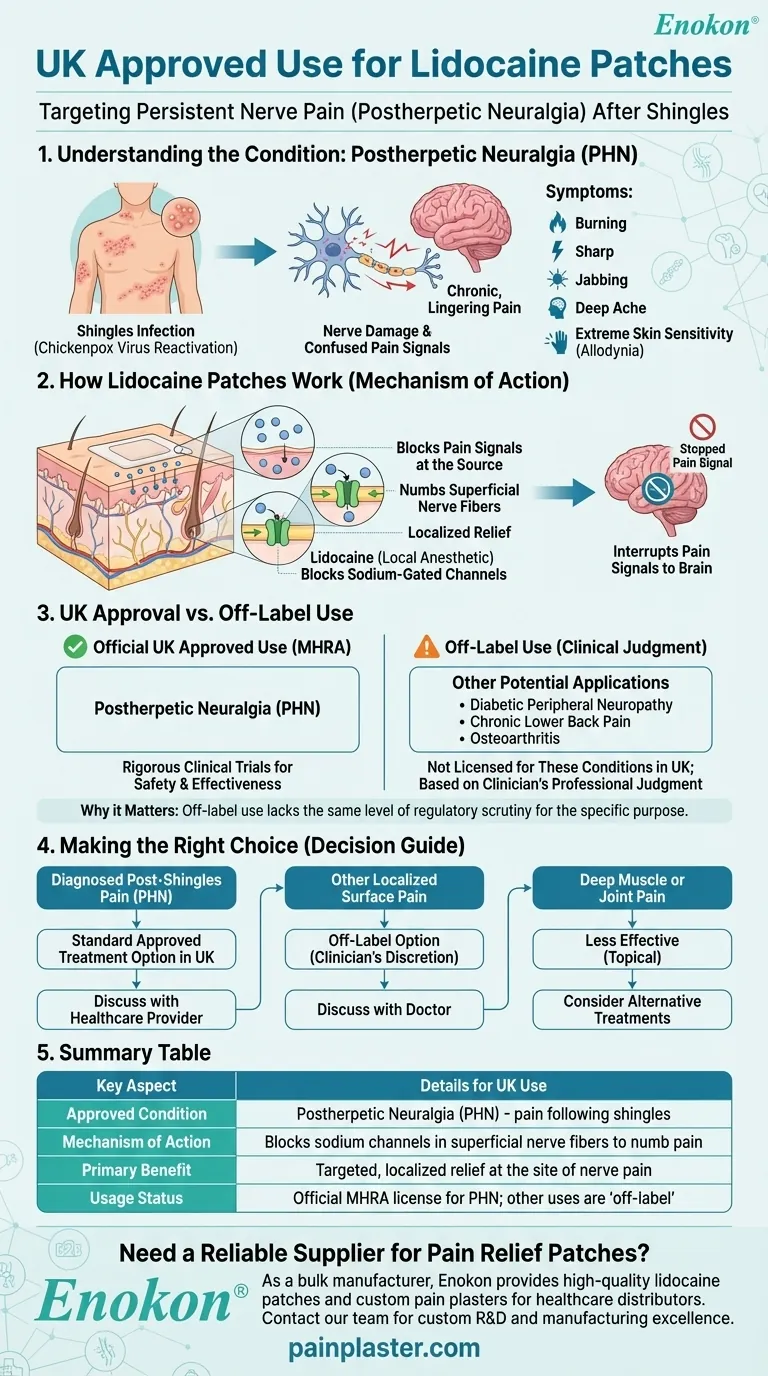
En el Reino Unido, parches de lidocaína están aprobados específicamente para el tratamiento de la neuralgia posherpética (NPH), un dolor nervioso persistente que puede aparecer tras una infección por herpes zóster.Aunque las investigaciones sugieren posibles usos fuera de lo indicado para otras dolencias, la aprobación del Reino Unido se centra exclusivamente en el tratamiento de la NPH.Esto difiere ligeramente de las aprobaciones más amplias de la FDA, lo que refleja las distinciones reguladoras regionales en los enfoques del tratamiento del dolor.

Explicación de los puntos clave:
-
Indicación principal aprobada en el Reino Unido
- Los parches de lidocaína están aprobados exclusivamente para la neuralgia postherpética (NPH) en el Reino Unido.
- La NPH es un síndrome de dolor neuropático posterior al herpes zóster (infección por herpes zóster), caracterizado por un dolor persistente en las zonas de la piel previamente afectadas.
-
Mecanismo de acción de la NPH
- Los parches administran lidocaína localizada (concentración del 5%) para bloquear las señales nerviosas anormales en los nervios periféricos dañados.
- La aplicación tópica minimiza la absorción sistémica, reduciendo los efectos secundarios en comparación con los analgésicos orales.
-
Contexto normativo
- La aprobación en el Reino Unido se ajusta al marco de la Agencia Europea de Medicamentos (EMA), que suele exigir pruebas clínicas sólidas para indicaciones específicas.
- A diferencia de la FDA, los organismos reguladores del Reino Unido y la UE no han ampliado la aprobación a otras afecciones de dolor neuropático (por ejemplo, la neuropatía diabética) a pesar de las nuevas investigaciones.
-
Consideraciones clínicas
- Los parches se aplican directamente sobre la piel intacta en las zonas doloridas durante un máximo de 12 horas al día.
- Las contraindicaciones incluyen hipersensibilidad a la lidocaína o a los componentes del parche.
-
Potencial de uso fuera de indicación
- Aunque no está aprobado en el Reino Unido, los estudios señalan su eficacia en la osteoartritis, el dolor de espalda crónico y el dolor posquirúrgico.
- Los prescriptores pueden considerar el uso fuera de indicación en función de las necesidades individuales del paciente y de la evaluación de riesgos y beneficios.
-
Implicaciones de compra
- Las adquisiciones sanitarias deben dar prioridad a las formulaciones verificadas y aprobadas por el Reino Unido para el tratamiento de la NPH.
- Para aplicaciones de investigación o ampliadas, los protocolos institucionales pueden requerir una justificación adicional.
La aprobación selectiva del Reino Unido refleja un enfoque prudente del tratamiento del dolor neuropático, haciendo hincapié en el uso basado en la evidencia para la NPH, al tiempo que reconoce un potencial terapéutico más amplio a través de la investigación en curso.
Tabla resumen:
| Aspecto clave | Detalles |
|---|---|
| Afección aprobada | Neuralgia postherpética (NPH) únicamente |
| Mecanismo de acción | Administración localizada de lidocaína al 5% para bloquear las señales nerviosas anormales |
| Pautas de aplicación | Aplicar sobre la piel intacta durante ≤12 horas/día; evitar zonas hipersensibles |
| Ámbito reglamentario | Aprobación alineada con la EMA (sin extensión al Reino Unido para otras afecciones de dolor neuropático) |
| Potencial fuera de indicación | Osteoartritis, dolor de espalda crónico (requiere discreción del prescriptor) |
¿Necesita parches de lidocaína fiables para el tratamiento de la NPH? Como fabricante a granel de confianza de soluciones transdérmicas para el alivio del dolor, Enokon ofrece:
- Fórmulas conformes al Reino Unido para el tratamiento de la neuralgia postherpética
- Apoyo personalizado en I+D para distribuidores y marcas del sector sanitario
- Producción con certificación GMP garantizando una calidad y eficacia constantes
Póngase en contacto con nuestro equipo para hablar de sus necesidades de adquisición o desarrollo.
Guía Visual
Productos relacionados
- Parche analgésico de hidrogel de lidocaína para el alivio del dolor
- Parches analgésicos con capsaicina y chile
- Parches Calor Profundo Infrarrojo Parches Analgésicos Medicinales
- Parche antitusígeno y analgésico para adultos y niños
- Parches térmicos analgésicos para los dolores menstruales
La gente también pregunta
- ¿Cuál es el principio activo del parche Lidoderm?Lidocaína para el alivio selectivo del dolor
- ¿Cómo debe almacenarse y eliminarse la lidocaína transdérmica?Directrices esenciales de seguridad
- ¿Qué informes posteriores a la comercialización se han asociado a los parches transdérmicos de lidocaína?Principales efectos adversos y seguridad
- ¿Cuáles son algunos de los usos no indicados del parche Lidoderm?Explorando opciones alternativas para el alivio del dolor
- ¿Qué datos proporciona un analizador de tamaño de partículas para nano-liposomas de Lidocaína? Optimice sus formulaciones transdérmicas
- ¿Qué se debe hacer en caso de sobredosis de lidocaína tópica?Medidas de emergencia y consejos de prevención
- ¿Qué precauciones especiales se aplican al uso de parches de lidocaína?Consejos de seguridad esenciales para un alivio eficaz del dolor
- ¿Qué efectos secundarios raros pero graves requieren atención médica inmediata cuando se utiliza lidocaína tópica?
















