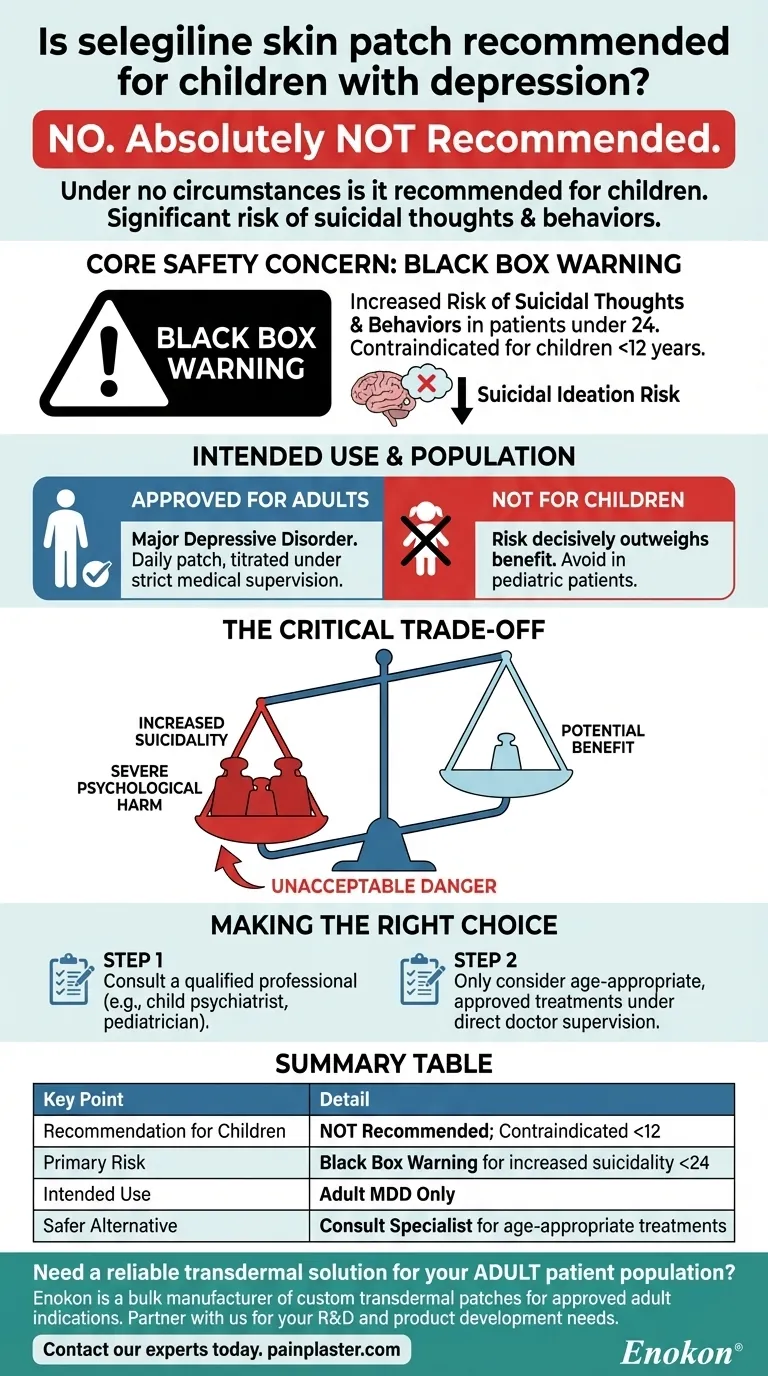
El parche cutáneo de selegilina no se recomienda para el tratamiento de la depresión en niños debido a importantes problemas de seguridad, en particular el riesgo de pensamientos o intentos suicidas en poblaciones pediátricas.Las pruebas clínicas y las directrices de prescripción desaconsejan sistemáticamente su uso en niños menores de 12 años, y las precauciones más amplias se extienden a adolescentes y adultos jóvenes.El protocolo de administración del medicamento (6-12 mg/24 horas a través de la piel intacta) también presenta dificultades prácticas para su uso pediátrico.

Explicación de los puntos clave:
-
Contraindicación para uso pediátrico
- Los parches transdérmicos de selegilina están explícitamente contraindicados para niños menores de 12 años en múltiples fuentes autorizadas.Esta restricción se basa en perfiles de seguridad documentados más que en limitaciones de dosificación.
-
Elevado riesgo de suicidio
- Los estudios clínicos revelan un mayor riesgo de ideación y comportamiento suicidas en niños, adolescentes y adultos jóvenes que toman antidepresivos como la selegilina.Esto coincide con las advertencias de recuadro negro de la FDA para medicamentos IMAO similares.
-
Problemas de administración
-
El protocolo estándar requiere la aplicación diaria sobre la piel intacta (parte superior del brazo/torso/muslos) con un aumento gradual de la dosis (6 mg→12 mg a lo largo de semanas).Los pacientes pediátricos pueden tener dificultades con:
- Adherencia constante del parche debido a los mayores niveles de actividad
- Ajustes precisos de la dosis necesarios para una masa corporal menor
- Riesgo de ingestión accidental si se manipulan mal los parches
-
El protocolo estándar requiere la aplicación diaria sobre la piel intacta (parte superior del brazo/torso/muslos) con un aumento gradual de la dosis (6 mg→12 mg a lo largo de semanas).Los pacientes pediátricos pueden tener dificultades con:
-
Consideraciones sobre tratamientos alternativos
Aunque los parches de selegilina no son adecuados, el tratamiento de la depresión pediátrica suele incluir- ISRS con perfiles de seguridad establecidos (por ejemplo, fluoxetina para ≥8 años).
- Terapia cognitivo-conductual como intervención de primera línea
- Seguimiento estrecho durante el inicio de la medicación
-
Consenso normativo
Múltiples agencias de seguridad de medicamentos desaconsejan uniformemente el uso fuera de indicación en pediatría, haciendo hincapié en:- Falta de datos de eficacia para la depresión infantil
- Efectos irreversibles de los IMAO que pueden afectar de forma desproporcionada a los sistemas neurotransmisores en desarrollo.
Para los compradores de atención sanitaria, esto subraya la importancia de almacenar alternativas apropiadas para la edad y garantizar que los prescriptores tengan acceso a las advertencias de seguridad actuales sobre el uso de antidepresivos en poblaciones pediátricas.
Tabla resumen:
| Preocupación clave | Detalles |
|---|---|
| Restricciones de edad | Contraindicado para niños <12 años |
| Riesgo de suicidio | Advertencia de recuadro negro por ideación suicida en consumidores jóvenes |
| Dificultades de dosificación | Adherencia difícil y ajustes precisos para masas corporales pequeñas |
| Alternativas | Preferiblemente ISRS (p. ej., fluoxetina) + terapia |
| Postura reguladora | Las agencias internacionales prohíben el uso pediátrico fuera de lo indicado |
¿Necesita soluciones transdérmicas fiables y adecuadas para su edad? Como fabricante de confianza de parches conformes con la FDA, Enokon se especializa en sistemas seguros de administración de fármacos para todos los grupos de pacientes. Póngase en contacto con nuestros expertos para hablar de alternativas comprobadas para el tratamiento de la salud mental pediátrica o de I+D personalizado para sus necesidades de formulario.
Guía Visual
Productos relacionados
- Parches Calor Profundo Infrarrojo Parches Analgésicos Medicinales
- Parches analgésicos con capsaicina y chile
- Parche Infrarrojo Lejano para el Alivio del Dolor de Espalda
- Parche antitusígeno y analgésico para adultos y niños
- Parche analgésico de gel mentolado
La gente también pregunta
- ¿Cuáles son las ventajas de la rivastigmina transdérmica frente a las cápsulas orales?Mejor cumplimiento y menos efectos secundarios
- ¿Por qué se utilizan los ácidos grasos de cadena larga como el ácido oleico en los potenciadores transdérmicos? Aumenta la absorción y la fluidez lipídica
- ¿Para qué se utiliza la rivastigmina transdérmica?Control eficaz de los síntomas de la demencia
- ¿Quién no debe utilizar nitroglicerina transdérmica?Contraindicaciones clave para un uso seguro
- ¿Por qué se utiliza típicamente un apósito de película transparente con parches transdérmicos en ensayos clínicos? Garantizar la integridad de los datos
- ¿Qué enfermedades preexistentes deben revelarse antes de utilizar el parche para la enfermedad de Parkinson?Garantizar un tratamiento seguro y eficaz
- ¿Cómo pueden ayudar los parches de estrógenos con los síntomas de la menopausia?Alivio y beneficios a largo plazo
- ¿Qué se debe hacer en caso de sobredosis de granisetrón en parche?Medidas de emergencia y prevención
















