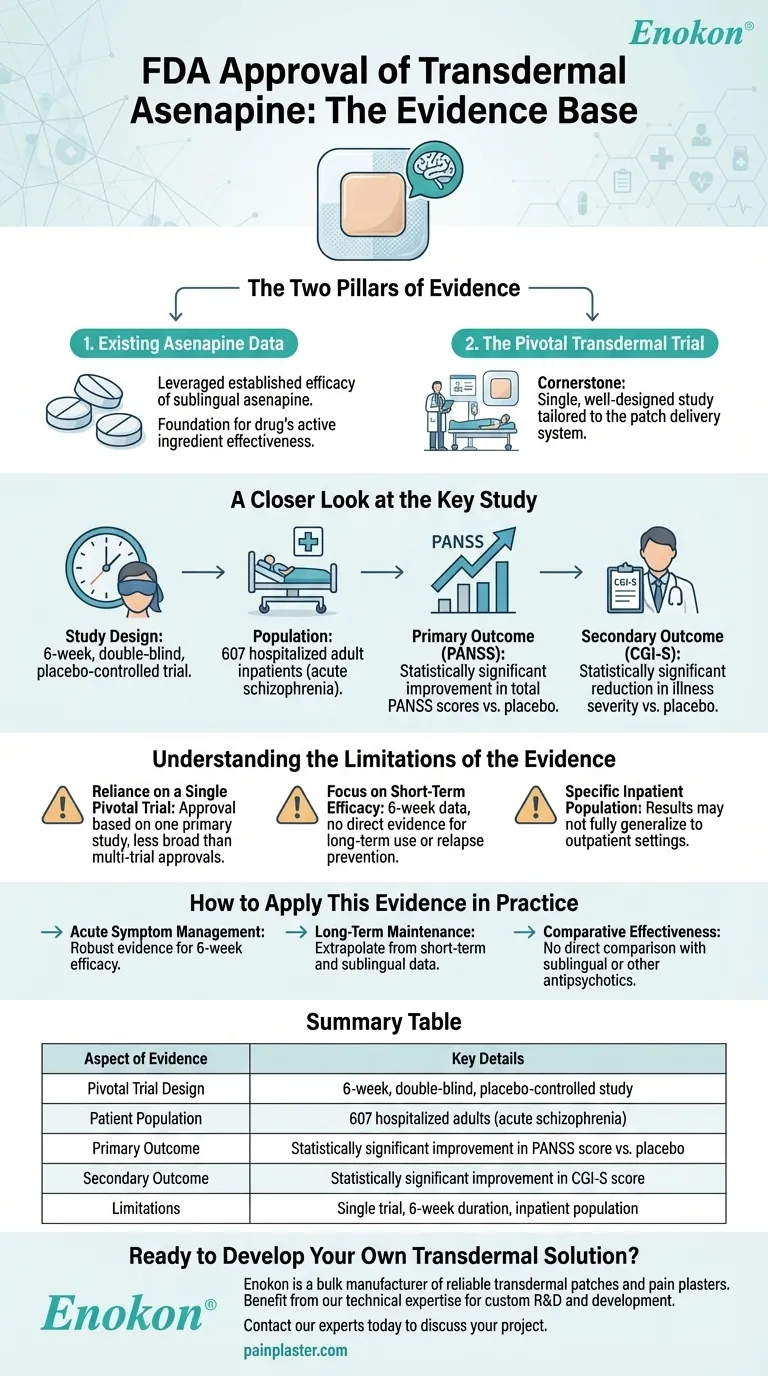
La aprobación de la FDA del parche de asenapina (asenapina transdérmica) se apoyó en una combinación de datos de eficacia previos de estudios sobre asenapina sublingual y un ensayo fundamental de 6 semanas, doble ciego y controlado con placebo, en el que participaron 607 pacientes adultos hospitalizados con esquizofrenia.La formulación transdérmica demostró mejoras estadísticamente significativas en los criterios de valoración primarios (puntuaciones PANSS) y secundarios (calificaciones CGI-S) en comparación con el placebo, lo que confirma su beneficio terapéutico.Estas pruebas establecieron colectivamente la seguridad, eficacia y relevancia clínica del parche para el tratamiento de la esquizofrenia.
Explicación de los puntos clave:
-
Datos anteriores sobre la eficacia de la asenapina sublingual
- Los ensayos previos que evaluaron la asenapina sublingual proporcionaron pruebas fundamentales del mecanismo de acción del fármaco y de su potencial terapéutico en la esquizofrenia.
- Estos estudios probablemente informaron sobre la dosificación, los perfiles de seguridad y los resultados esperados para la formulación transdérmica, agilizando la vía de aprobación.
-
Ensayo pivotal doble ciego de 6 semanas de duración
- Diseño del estudio:Un ensayo riguroso, controlado con placebo, con 607 participantes, garantizó una potencia estadística sólida y minimizó el sesgo.
- Población:Centrado en pacientes adultos hospitalizados con esquizofrenia, lo que refleja el objetivo demográfico para uso clínico.
- Duración:El plazo de 6 semanas equilibró la evaluación de los síntomas agudos con la aplicabilidad clínica práctica.
-
Criterio de valoración primario:Puntuaciones PANSS
- La Escala de Síntomas Positivos y Negativos (PANSS) es un patrón de referencia para evaluar la gravedad de los síntomas de la esquizofrenia.
- Las mejoras estadísticamente significativas en las puntuaciones de la PANSS confirmaron la eficacia del parche en la reducción de los síntomas positivos (por ejemplo, alucinaciones) y negativos (por ejemplo, retraimiento social).
-
Criterio de valoración secundario:Calificaciones de la CGI-S
- La escala Clinical Global Impression-Severity (CGI-S) proporcionó una validación de la mejoría de los síntomas comunicada por el clínico.
- La significación en este caso reforzó los beneficios clínicos observables y específicos del paciente.
-
Seguridad y tolerabilidad
- Aunque no se detalla explícitamente en las referencias, la aprobación de la FDA implica que la formulación transdérmica cumplió los criterios de seguridad, probablemente aprovechando los datos sublinguales y los nuevos informes de eventos adversos de los ensayos.
- La administración transdérmica puede ofrecer ventajas como la reducción de los efectos secundarios sistémicos (por ejemplo, frente a las vías oral o inyectable).
-
Fundamento normativo
- La decisión de la FDA se basó en una eficacia reproducible (PANSS/CGI-S) y un claro perfil de riesgos y beneficios, respaldado por datos de ensayos controlados.
- La conveniencia del parche y las ventajas en cuanto a adherencia (por ejemplo, liberación sostenida, vía no oral) pueden haber justificado aún más la aprobación para una población que a menudo tiene dificultades para cumplir con la medicación.
Para los compradores de atención sanitaria, esta evidencia subraya la importancia del parche de asenapina. parche de asenapina como una opción viable y respaldada por la evidencia para el tratamiento de la esquizofrenia, con posibles ventajas en cuanto a administración y tolerabilidad.¿Se ajustaría su formato transdérmico a las necesidades de sus pacientes o a los protocolos institucionales?
Tabla resumen:
| Pruebas clave para la aprobación de la FDA | Detalles |
|---|---|
| Datos anteriores sobre la asenapina sublingual | Mecanismo de acción y perfil de seguridad establecidos |
| Ensayo pivotal de 6 semanas | 607 pacientes adultos hospitalizados con esquizofrenia, doble ciego, controlado con placebo |
| Criterio de valoración primario (puntuaciones PANSS) | Reducción estadísticamente significativa de los síntomas |
| Criterio de valoración secundario (valoraciones de la CGI-S) | Mejora de la gravedad confirmada por el clínico |
| Seguridad y tolerabilidad | Cumple los criterios de la FDA, posibles beneficios para la adherencia |
| Justificación reglamentaria | Eficacia reproducible y claro perfil de riesgos y beneficios |
¿Está interesado en integrar la asenapina transdérmica en sus protocolos de tratamiento?
Como fabricante a granel de confianza de parches transdérmicos y apósitos para el dolor, Enokon ofrece soluciones fiables y clínicamente validadas para distribuidores sanitarios y marcas farmacéuticas.Nuestra experiencia en I+D a medida garantiza formulaciones adaptadas a las necesidades de sus pacientes.
Póngase en contacto con nosotros para hablar de oportunidades de asociación o solicitar muestras de productos.
Guía Visual
Productos relacionados
- Parche antitusígeno y analgésico para adultos y niños
- Parche analgésico de gel mentolado
- Parche analgésico Icy Hot Menthol Medicine
- Parches Calor Profundo Infrarrojo Parches Analgésicos Medicinales
- Parche protector ocular a base de plantas
La gente también pregunta
- ¿Cómo se deben tratar las dosis olvidadas del parche Reliever?Pautas de uso seguro
- ¿Son seguros los parches analgésicos para pieles sensibles?Cómo utilizarlos con seguridad
- ¿Pueden las embarazadas utilizar parches analgésicos?Seguridad y alternativas
- ¿Cómo proporciona el parche antitusígeno un alivio localizado?Descubra la ciencia que hay detrás del alivio localizado
- ¿Qué hace que el parche antitusígeno sea una opción cómoda para controlar la tos?Alivio rápido y natural sobre la marcha















