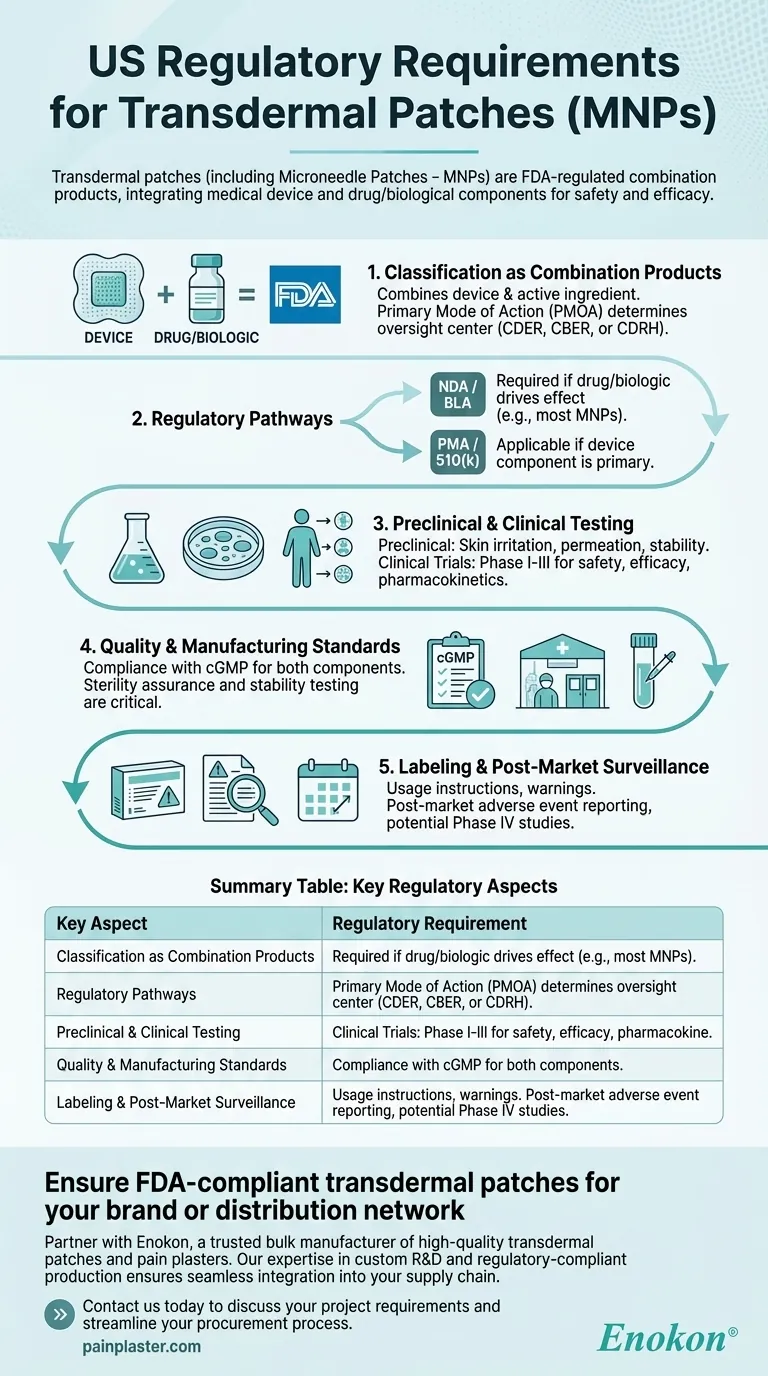
Los parches transdérmicos, incluidos los parches de microagujas (MNP), están regulados en EE.UU. como productos combinados por la FDA, lo que exige rigurosos procesos de aprobación para garantizar su seguridad y eficacia. Estos productos integran componentes de dispositivos médicos y fármacos/biológicos, lo que exige el cumplimiento de vías reglamentarias específicas en función de su modo de acción primario. El proceso de aprobación implica pruebas preclínicas y clínicas, control de calidad y cumplimiento de las normas de etiquetado y fabricación.
Explicación de los puntos clave:
-
Clasificación como productos combinados
- La FDA clasifica parches transdérmicos como productos combinados porque combinan un dispositivo médico (por ejemplo, soporte del parche, microagujas) con un fármaco o principio activo biológico.
- El modo de acción primario (PMOA) determina si el producto está regulado por el Centro de Evaluación e Investigación de Medicamentos (CDER), el Centro de Evaluación e Investigación de Productos Biológicos (CBER) o el Centro de Dispositivos y Salud Radiológica (CDRH).
-
Vías reglamentarias
- Solicitud de nuevo fármaco (NDA) o solicitud de licencia biológica (BLA): Necesaria si el fármaco o componente biológico impulsa el efecto terapéutico.
- Aprobación previa a la comercialización (PMA) o 510(k): Aplicable si el componente del dispositivo es primario (por ejemplo, microagujas que facilitan la administración del fármaco).
- Los MNP suelen seguir la ruta NDA/BLA debido a su función centrada en el fármaco.
-
Pruebas preclínicas y clínicas
- Estudios preclínicos: Incluyen pruebas de irritación cutánea, permeación y estabilidad para evaluar la seguridad y la eficacia de la administración.
- Ensayos clínicos: Los ensayos de fase I-III evalúan la farmacocinética, la eficacia y los efectos adversos en humanos.
-
Normas de calidad y fabricación
- Cumplimiento de las Buenas Prácticas de Fabricación Actuales (cGMP) tanto para fármacos como para componentes de dispositivos.
- La garantía de esterilidad y las pruebas de estabilidad son fundamentales para los parches con productos biológicos.
-
Etiquetado y vigilancia posterior a la comercialización
- Las etiquetas deben incluir instrucciones de uso, advertencias y condiciones de almacenamiento.
- Los requisitos posteriores a la comercialización incluyen la notificación de acontecimientos adversos y posibles estudios de fase IV.
Para los compradores, la comprensión de estos requisitos garantiza la alineación con los proveedores que cumplen con la FDA, reduciendo los riesgos de productos no conformes. ¿Se ha planteado cómo afectan estas normativas a sus plazos de adquisición o a sus criterios de selección de proveedores? La interacción de la supervisión de dispositivos y fármacos determina en silencio la fiabilidad de las terapias transdérmicas modernas.
Tabla resumen:
| Aspecto clave | Requisito normativo |
|---|---|
| Clasificación | Regulados como productos combinados (dispositivo + fármaco/biológico) por la FDA. |
| Modo de acción primario | Determina la supervisión por parte del CDER (fármaco), CBER (biológico) o CDRH (dispositivo). |
| Vías de aprobación | NDA/BLA (medicamento) o PMA/510(k) (dispositivo). Los PNM suelen seguir la NDA/BLA. |
| Requisitos de ensayo | Ensayos preclínicos (seguridad, permeabilidad) y clínicos (fases I-III). |
| Normas de fabricación | Cumplimiento de las cGMP tanto para medicamentos como para componentes de dispositivos; garantía de esterilidad para productos biológicos. |
| Obligaciones posteriores a la comercialización | Notificación de acontecimientos adversos, estudios de fase IV y conformidad del etiquetado. |
Garantice parches transdérmicos conformes con la FDA para su marca o red de distribución
Asociarse con
Enokon
un fabricante a granel de confianza de parches transdérmicos y apósitos analgésicos de alta calidad. Nuestra experiencia en I+D personalizada y producción conforme a la normativa garantiza una integración perfecta en su cadena de suministro.
Póngase en contacto con nosotros
para hablar de los requisitos de su proyecto y agilizar su proceso de adquisición.
Guía Visual
Productos relacionados
- Calor infrarrojo lejano Parches analgésicos Parches transdérmicos
- Parches térmicos analgésicos para los dolores menstruales
- Parche Heat Relief Capsicum para aliviar el dolor lumbar
- Parches analgésicos con capsaicina y chile
- Parches médicos de gel refrigerante para la fiebre Parches refrigerantes
La gente también pregunta
- ¿Cuáles son las principales características del parche antidolor de espalda Deep Heat?Alivio duradero y sin medicamentos
- ¿Son seguros los parches térmicos para todas las partes del cuerpo?Pautas clave para un uso seguro
- ¿Cómo actúa la capsaicina en el parche térmico medicamentoso?La ciencia del alivio del dolor
- ¿Para qué tipos de dolor se puede utilizar el Parche de Calor Profundo para el Alivio del Dolor de Espalda?Aliviar molestias musculoesqueléticas de forma natural
- ¿Cómo funciona el parche para el dolor de espalda Deep Heat Pain Relief?Alivio del dolor sin medicamentos con calor terapéutico