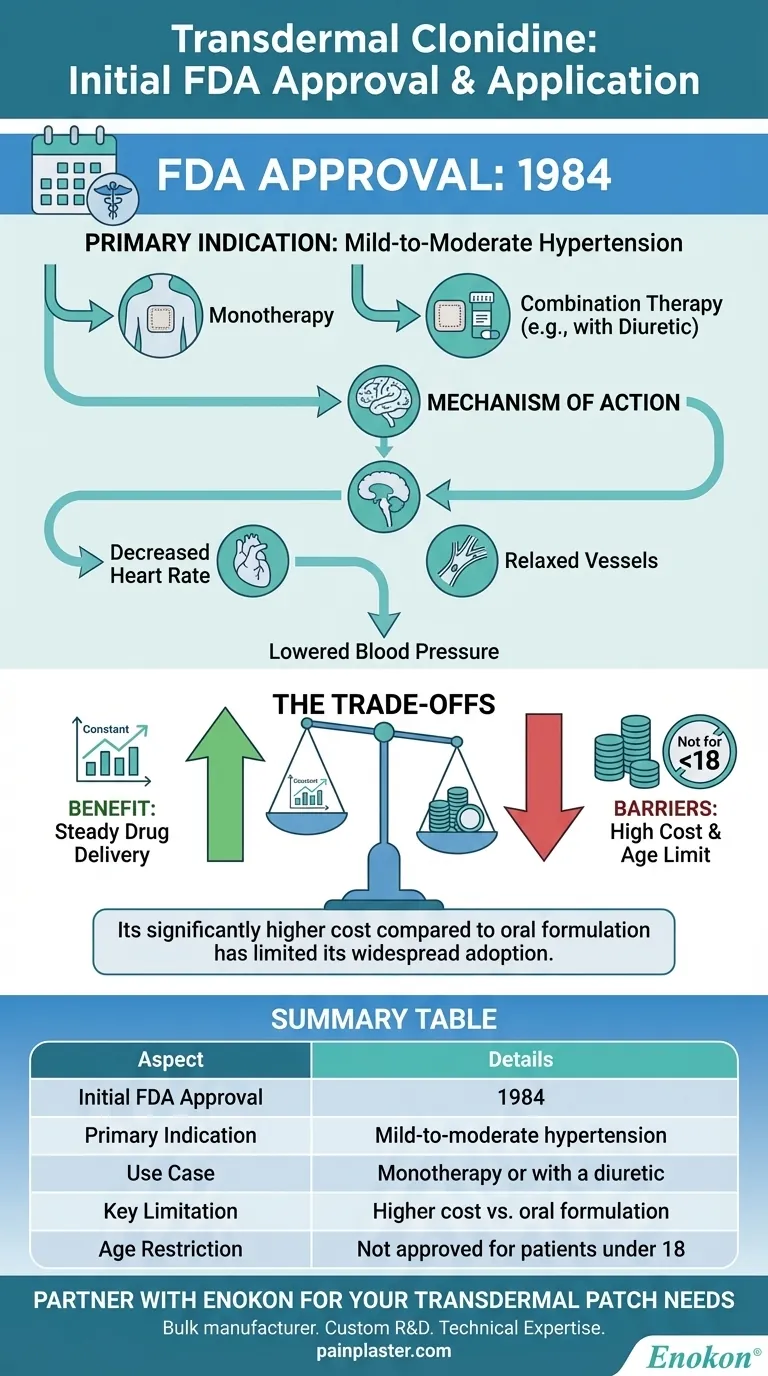
La clonidina transdérmica fue aprobada inicialmente por la Food and Drug Administration (FDA) de EE.UU. en 1984 para el tratamiento de la hipertensión de leve a moderada, como tratamiento independiente o en combinación con un diurético.Esta aprobación supuso la introducción de un nuevo método de administración de la clonidina, aprovechando su capacidad para reducir la presión arterial a través de mecanismos alfa-agonistas centrales.El parche transdérmico ofrecía ventajas como la liberación sostenida del fármaco y un mejor cumplimiento terapéutico por parte del paciente, lo que supuso en su momento un avance significativo en el tratamiento de la hipertensión.
Explicación de los puntos clave:
-
Aprobación inicial de la FDA (1984)
- El parche transdérmico de clonidina recibió la aprobación de la FDA en 1984, específicamente para el tratamiento de la hipertensión de leve a moderada.
- Esta aprobación validó su eficacia como monoterapia o complemento de los diuréticos, abordando una necesidad crítica de opciones antihipertensivas de acción prolongada.
-
Indicación principal:Hipertensión
-
El parche fue diseñado para proporcionar una administración continua de clonidina, reduciendo la presión arterial mediante:
- Disminuyendo el ritmo cardíaco.
- Relajación de los vasos sanguíneos para mejorar la circulación.
- Su clasificación como agente hipotensor alfa-agonista de acción central subraya su mecanismo de acción en el tronco encefálico para modular el flujo simpático.
-
El parche fue diseñado para proporcionar una administración continua de clonidina, reduciendo la presión arterial mediante:
-
Ventajas de la administración transdérmica
- A diferencia de las formulaciones orales, el parche garantizaba niveles estables del fármaco, minimizando las fluctuaciones entre los valores máximos y mínimos.
- La reducción de la frecuencia de dosificación (por ejemplo, aplicación semanal) mejoró la adherencia, sobre todo en enfermedades crónicas como la hipertensión.
-
Restricciones de edad
- En particular, la forma transdérmica no se aprobó para pacientes menores de 18 años, lo que refleja los limitados datos de seguridad en poblaciones pediátricas en ese momento.
-
Contexto histórico
- La aprobación de 1984 representó una innovación en la administración de fármacos, en consonancia con las tendencias más amplias hacia terapias no orales para las enfermedades cardiovasculares.
- Complementaba a la clonidina oral existente, ofreciendo una alternativa a los pacientes con problemas de tolerabilidad gastrointestinal.
El parche transdérmico de clonidina sigue siendo un testimonio de cómo los sistemas de administración de fármacos dirigidos pueden transformar el tratamiento de las enfermedades crónicas, optimizando silenciosamente la terapia a través de la ciencia a flor de piel.
Tabla resumen:
| Aspecto clave | Detalles |
|---|---|
| Año de aprobación de la FDA | 1984 |
| Indicación principal | Hipertensión de leve a moderada (monoterapia o con diuréticos) |
| Mecanismo de acción | Alfa-agonista de acción central, reduce el flujo simpático. |
| Principales ventajas | Liberación constante del fármaco, mejor cumplimiento terapéutico, dosificación semanal |
| Restricciones de edad | No aprobado para pacientes menores de 18 años |
¿Necesita soluciones transdérmicas fiables para la hipertensión o el dolor crónico?
Enokon se especializa en parches transdérmicos de alta calidad, combinando décadas de experiencia con I+D personalizable para marcas farmacéuticas y distribuidores.
Póngase en contacto con nosotros
para hablar de su proyecto: ¡innovemos juntos!
Guía Visual
Productos relacionados
- Calor infrarrojo lejano Parches analgésicos Parches transdérmicos
- Parches térmicos analgésicos para los dolores menstruales
- Parches Calor Profundo Infrarrojo Parches Analgésicos Medicinales
- Parche protector ocular a base de plantas
- Parche analgésico de gel mentolado
La gente también pregunta
- ¿Cómo alivian el dolor los parches de calor profundo?Terapia de calor dirigida para un confort duradero
- ¿Cuáles son los efectos secundarios habituales del uso del parche térmico medicamentoso?Comprender los riesgos y el uso seguro
- ¿Son seguros los parches térmicos para todas las partes del cuerpo?Pautas clave para un uso seguro
- ¿Se pueden utilizar parches térmicos para lesiones recientes?Por qué funciona mejor la terapia con frío
- ¿Cómo funciona el parche para el dolor de espalda Deep Heat Pain Relief?Alivio del dolor sin medicamentos con calor terapéutico
















