El parche Lidoderm, un parche analgésico tópico, recibió la aprobación de la FDA en 1999.Esta aprobación marcó su introducción como dispositivo médico para el alivio del dolor, aprovechando la lidocaína para proporcionar un tratamiento localizado.El diseño y la eficacia del parche cumplen las normas reglamentarias exigidas para este tipo de productos, lo que garantiza su disponibilidad para los pacientes que necesitan soluciones no invasivas para el tratamiento del dolor.
Explicación de los puntos clave:
-
Año de aprobación de la FDA:
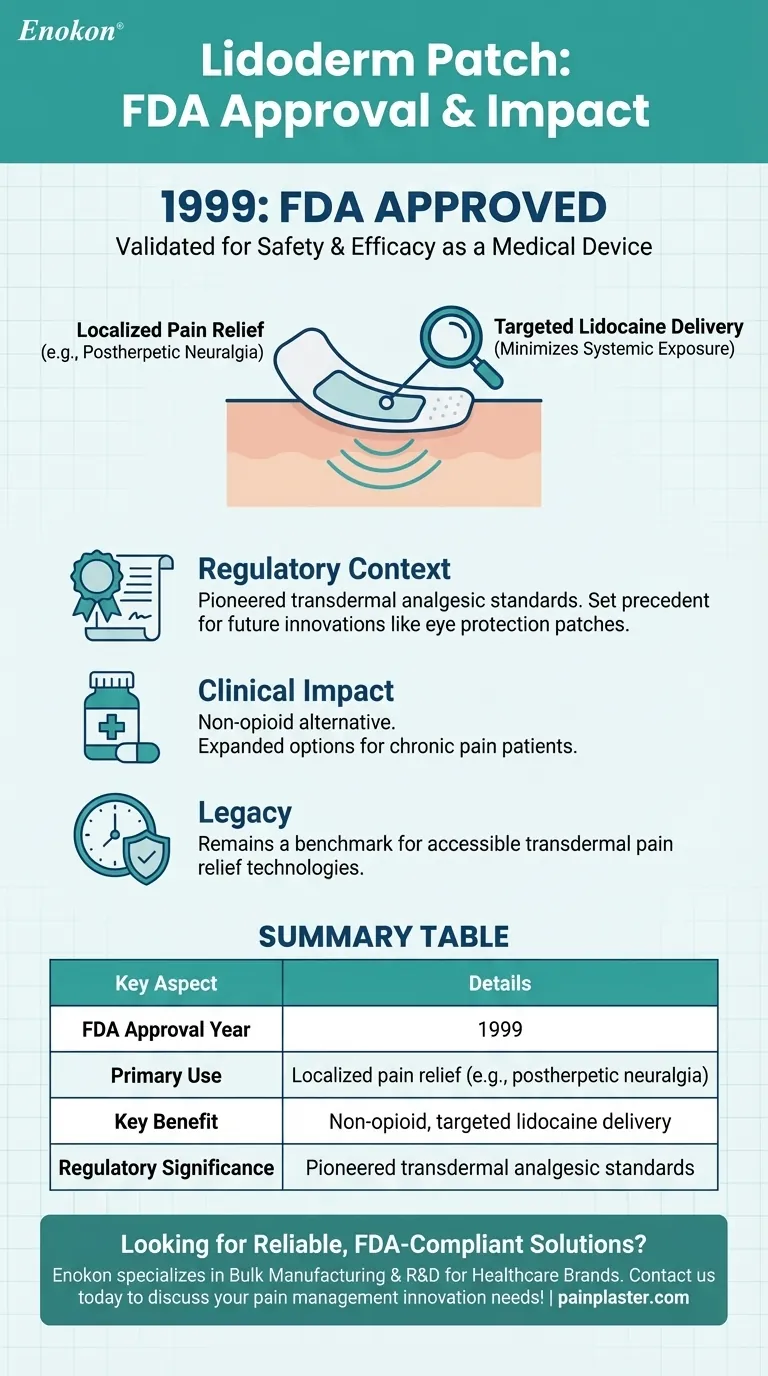
- El parche Lidoderm fue aprobado por la Administración de Alimentos y Medicamentos de EE.UU. (FDA) en 1999 .Este hito validó su seguridad y eficacia para uso clínico.
- El proceso de aprobación incluyó pruebas rigurosas para garantizar que el parche cumplía las normas de administración eficaz de lidocaína sin efectos secundarios sistémicos.
-
Objetivo y diseño:
- El parche está diseñado para proporcionar un alivio localizado del dolor, en particular para afecciones como la neuralgia postherpética (dolor relacionado con el herpes zóster).
- Su reverso adhesivo permite la administración localizada de lidocaína, minimizando la exposición a otras zonas del cuerpo.
-
Contexto normativo:
- La aprobación de la FDA en 1999 situó el parche Lidoderm entre las primeras innovaciones analgésicas tópicas.
- Sentó un precedente para productos similares, incluido el parche de protección ocular que siguieron posteriormente para diferentes aplicaciones terapéuticas.
-
Impacto clínico:
- El parche ofrecía una alternativa no opiácea para el tratamiento del dolor, en consonancia con el creciente énfasis en reducir el uso de fármacos sistémicos.
- Su aprobación amplió las opciones para los pacientes con dolor crónico, en particular los sensibles a los medicamentos orales.
El parche Lidoderm sigue siendo un referente en el alivio transdérmico del dolor, lo que refleja el papel de la FDA en el avance de las tecnologías sanitarias accesibles.
Cuadro recapitulativo:
| Aspecto clave | Detalles |
|---|---|
| Año de aprobación de la FDA | 1999 |
| Uso primario | Alivio del dolor localizado (por ejemplo, neuralgia postherpética) |
| Beneficio clave | Administración selectiva de lidocaína no opiácea con exposición sistémica mínima |
| Importancia normativa | Pioneros en normas analgésicas transdérmicas |
¿Busca soluciones analgésicas transdérmicas fiables y conformes con la FDA? Enokon está especializada en la fabricación a granel de parches analgésicos de alta calidad y en I+D a medida para marcas del sector sanitario. Póngase en contacto con nosotros para hablar de sus necesidades y aprovechar nuestra experiencia en innovación para el tratamiento del dolor.
Guía Visual
Productos relacionados
- Parche protector ocular a base de plantas
- Parche analgésico de hidrogel de lidocaína para el alivio del dolor
- Parche ocular Hydra Gel Health Care
- Parche analgésico Icy Hot Menthol Medicine
- Parche antitusígeno y analgésico para adultos y niños
La gente también pregunta
- ¿Los parches para las ojeras deben aplicarse antes o después de la crema hidratante?Optimice su rutina de cuidado de la piel
- ¿Qué factores deben tenerse en cuenta al comprar parches oculares?Guía esencial para un uso seguro y eficaz
- ¿Cómo mejoran los parches oculares la eficacia de las cremas para el contorno de ojos?Mejore su rutina de cuidado ocular
- ¿En cuánto tiempo se notan los resultados de los parches para las ojeras?Iluminación instantánea y beneficios a largo plazo
- ¿Pueden los parches oculares alisar las líneas de expresión y las arrugas? Hidratar y rellenar para una piel joven
















