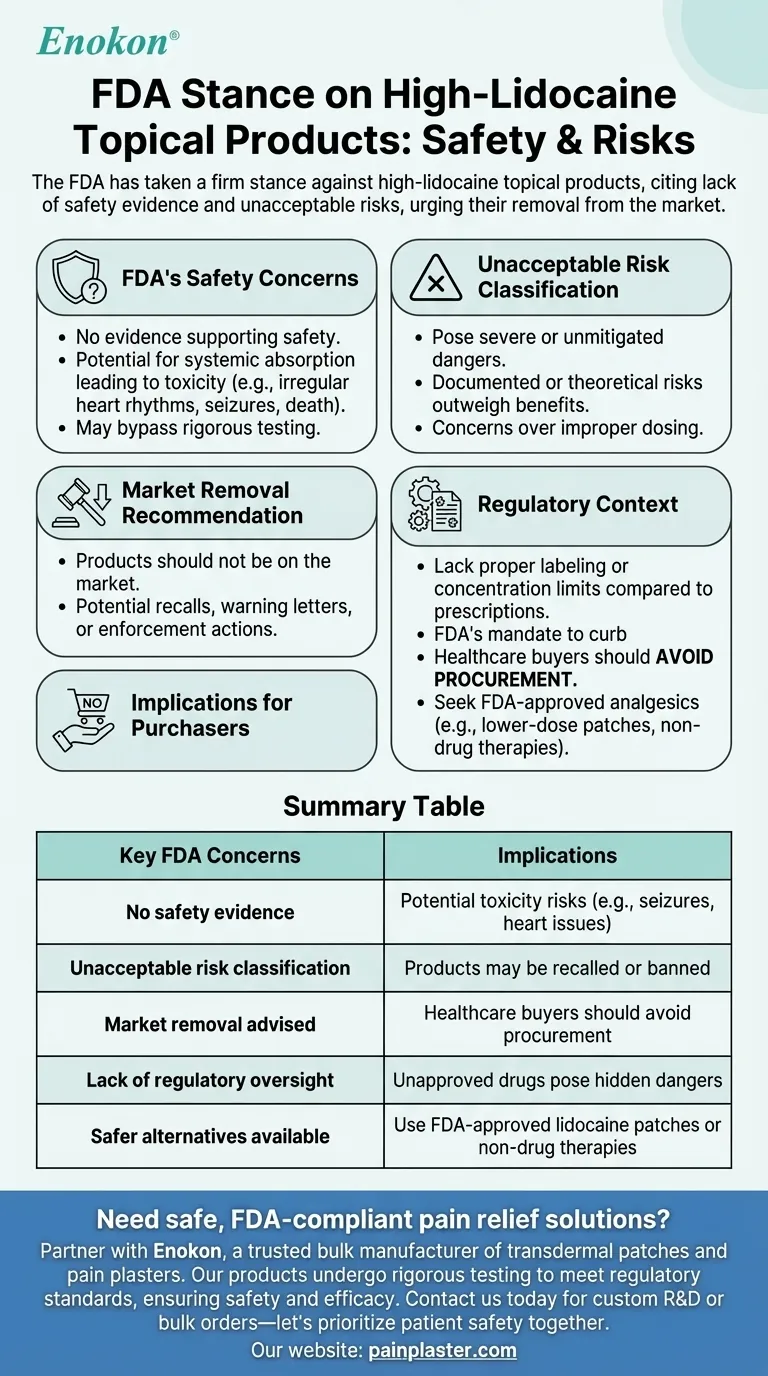
La FDA ha adoptado una postura firme contra los productos tópicos con alto contenido en lidocaína, alegando falta de pruebas de su seguridad y considerando que presentan riesgos inaceptables para los consumidores.La agencia afirma explícitamente que estos productos no deberían estar disponibles en el mercado debido a sus riesgos potenciales para la salud.Esta postura refleja la preocupación por las alegaciones de seguridad no verificadas y el potencial de uso indebido o efectos adversos, y subraya la necesidad de una supervisión reglamentaria más estricta para proteger la salud pública.

Explicación de los puntos clave:
-
Preocupaciones de seguridad de la FDA
- La FDA no ninguna prueba que respalden la seguridad de los productos tópicos con alto contenido en lidocaína.
- Esta falta de datos hace saltar las alarmas sobre posibles riesgos, como una absorción sistémica que provoque toxicidad (por ejemplo, ritmos cardíacos irregulares, convulsiones o incluso la muerte en casos extremos).
- La postura de la agencia implica que estos productos pueden eludir las rigurosas pruebas que se exigen a los medicamentos aprobados, lo que aumenta la incertidumbre sobre sus efectos.
-
Clasificación de riesgo inaceptable
- La FDA clasifica estos productos como productos que presentan riesgos inaceptables , una rara designación reservada a artículos con peligros graves o no mitigables.
- Esto sugiere que los efectos adversos documentados o los riesgos teóricos (por ejemplo, una dosificación inadecuada debido a la falta de estandarización) superan cualquier beneficio percibido.
-
Recomendación de retirada del mercado
- La afirmación de que estos productos no deberían estar en el mercado subraya el enfoque proactivo de la FDA en materia de protección del consumidor.
- Esto puede dar lugar a retiradas del mercado, cartas de advertencia a los fabricantes o medidas coercitivas contra los distribuidores.
-
Contexto normativo
- A diferencia de la lidocaína de venta con receta (que cuenta con controles de dosificación y supervisión clínica), los productos de venta libre con alto contenido en lidocaína pueden carecer de un etiquetado adecuado o de límites de concentración.
- La posición de la FDA está en consonancia con su mandato de poner freno a los medicamentos no aprobados que se hacen pasar por remedios tópicos.
-
Implicaciones para los compradores
- Los compradores del sector sanitario deben evitar la adquisición de dichos productos hasta que haya más pruebas o una reformulación que responda a las preocupaciones de la FDA.
- Los analgésicos alternativos aprobados por la FDA (por ejemplo, parches de lidocaína de dosis más baja o terapias no farmacológicas) pueden ser sustitutos más seguros.
La advertencia de la FDA sirve como recordatorio crítico de los peligros ocultos en productos OTC aparentemente benignos, instando tanto a los consumidores como a los profesionales a dar prioridad a los datos de seguridad verificados sobre las afirmaciones anecdóticas.
Cuadro sinóptico:
| Principales preocupaciones de la FDA | Implicaciones |
|---|---|
| No hay pruebas de seguridad | Riesgos potenciales de toxicidad (por ejemplo, convulsiones, problemas cardíacos) |
| Clasificación de riesgo inaceptable | Los productos pueden ser retirados o prohibidos |
| Se aconseja la retirada del mercado | Los compradores del sector sanitario deben evitar las adquisiciones |
| Falta de supervisión reglamentaria | Los medicamentos no aprobados plantean peligros ocultos |
| Existen alternativas más seguras | Utilice parches de lidocaína aprobados por la FDA o terapias no farmacológicas |
¿Necesita soluciones analgésicas seguras y conformes con la FDA? Colabore con Enokon es un fabricante de confianza de parches transdérmicos y apósitos analgésicos a granel para distribuidores y marcas del sector sanitario.Nuestros productos se someten a rigurosas pruebas para cumplir las normas reglamentarias, lo que garantiza su seguridad y eficacia. Póngase en contacto con nosotros para I+D a medida o pedidos al por mayor: demos prioridad juntos a la seguridad del paciente.
Guía Visual
Productos relacionados
- Parche analgésico de hidrogel de lidocaína para el alivio del dolor
- Parches analgésicos con capsaicina y chile
- Parches Calor Profundo Infrarrojo Parches Analgésicos Medicinales
- Parches médicos de gel refrigerante para la fiebre Parches refrigerantes
- Parche analgésico Icy Hot Menthol Medicine
La gente también pregunta
- ¿Cómo deben aplicarse los parches de lidocaína de forma segura?Pasos esenciales para un alivio eficaz del dolor
- ¿Para qué se utilizan los parches de lidocaína?Alivio selectivo del dolor crónico y nervioso
- ¿Qué son los parches de lidocaína y cómo funcionan?Explicación del alivio selectivo del dolor
- ¿Cuáles son los puntos clave sobre la seguridad de los parches de lidocaína?Pautas esenciales para un uso seguro
- ¿Cuáles son las alternativas a los parches de lidocaína para el dolor lumbar?Explore opciones eficaces para aliviar el dolor
















